Introduzione
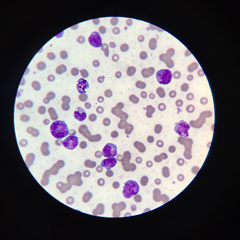
La leucemia linfoblastica acuta (LLA) è un tumore del sangue caratterizzato dalla presenza di un numero abnorme di globuli bianchi immaturi, scarsamente differenziati, portatori di mutazioni genetiche, nel midollo osseo, nel sangue e nei siti extramidollari. Questa condizione nasce da anomalie presenti nel midollo osseo, riguardanti un’espressione anomala di alcuni geni coinvolti nella regolazione del ciclo cellulare.
Per leucemia acuta si intende una progressione rapida e aggressiva che richiede, pertanto, una cura immediata. In circa l’85% dei casi i linfociti coinvolti sono di tipo B (quelli che producono anticorpi), il restante numero di casi origina dai linfociti T (quelli responsabili dell’immunità cellulare).
Effetti della leucemia linfoblastica acuta
Tutte le cellule del sangue sono prodotte dal midollo osseo, un tessuto spugnoso che si trova all'interno delle ossa. Il midollo è la sede in cui si trovano, e vengono mantenute per tutta la vita di un individuo, le cellule staminali, cellule madri, che hanno la capacità di dare origine, attraverso un processo di maturazione e differenziazione, a tre importanti popolazioni di cellule del sangue: i globuli rossi, che trasportano l'ossigeno in tutto il corpo; i globuli bianchi che aiutano a combattere le infezioni; le piastrine che intervengono nella coagulazione del sangue.
In condizioni normali, le cellule immature non vengono immesse in circolazione prima di aver raggiunto il differenziamento terminale. Nella leucemia linfoblastica acuta, invece, il midollo osseo comincia a rilasciare nel sangue un gran numero di cellule linfoidi parzialmente differenziate chiamate linfoblasti che hanno la capacità di proliferare in maniera abnorme.
In questo modo l'intero ciclo di sviluppo, mantenimento e morte delle cellule, un processo altamente preciso ed efficiente, viene alterato e i linfociti maturi vengono, così, in poco tempo, sostituiti da quelli leucemici; all'aumentare del numero dei blasti immaturi corrisponde, nel sangue, una diminuzione dei globuli rossi e delle piastrine. La carenza di globuli rossi causa anemia e quindi pallore, debolezza, affaticabilità, tachicardia. La carenza di piastrine può portare a emorragie (cioè perdita di sangue) dalla pelle e dalle mucose (gengive). In alcuni casi possono aversi anche emorragie gravi. La carenza di globuli bianchi sani (non leucemici) riduce le difese immunitarie e aumenta il rischio di infezioni, perché queste cellule leucemiche non sono in grado di svolgere le loro normali funzioni e di proteggere il corpo dalle infezioni. Le cellule tumorali possono infiltrarsi anche in altri organi, come il fegato, la milza e i linfonodi, causandone l'ingrossamento. A volte queste riescono a penetrare nel sistema nervoso, provocando paralisi.
Diffusione della leucemia linfoblastica acuta
La leucemia linfoblastica acuta è una malattia relativamente rara: in Italia si registrano circa 1,6 casi ogni 100.000 uomini e 1,2 casi ogni 100.000 donne, cioè circa 450 nuovi casi ogni anno tra gli uomini e 320 tra le donne.
Tuttavia, la LLA è il tumore più frequente tra i bambini, infatti rappresenta l'80% delle leucemie e circa il 25% di tutti i tumori diagnosticati tra 0 e 14 anni. La sua frequenza raggiunge il picco tra i 2 e i 5 anni e poi diminuisce con l'aumentare dell'età, fino ad essere minima dopo i 29 anni (il 50% di tutti i casi viene diagnosticato entro i 29 anni). Sebbene le cause della LLA siano multifattoriali, cioè fattori ambientali e fattori genetici interagiscono tra loro, giocando un ruolo chiave nella insorgenza della malattia, sono riconosciuti alcuni fattori di rischio, tra cui l'esposizione ad alti livelli di radiazioni, al fumo, ai pesticidi o al benzene.
Prospettive di guarigione
La prognosi per i bambini affetti da leucemia linfoblastica acuta è generalmente buona, eccezion fatta per le forme che si manifestano nel primo anno di vita. Quasi tutti raggiungono un periodo di remissione dei loro sintomi e l'85% dei pazienti guarisce completamente.
Per gli adulti invece la prognosi è meno benigna, dato che solo il 40% degli individui guarisce del tutto.
Sintomi
La comparsa dei sintomi è molto precoce, fin dalle prime fasi della malattia; infatti in qualche caso può portare a morte in poche settimane o qualche mese, se non si interviene subito con le terapie adatte. Nonostante ciò, una buona parte di esse può essere curata e guarita, soprattutto in soggetti giovani. I sintomi includono pallore, stanchezza, affanno, infezioni ripetute in un breve lasso di tempo, sanguinamento insolito e frequente dalle gengive o dal naso. Inoltre, possono essere presenti febbre a 38°C o più, sudorazioni notturne, dolori articolari e alle ossa, facilità alla formazione di lividi, ingrossamento dei linfonodi, dolore addominale causato dall'ingrossamento di fegato o milza, inspiegabile perdita di peso, porpora (piccole macchioline rosse diffuse sulla pelle).
In alcuni casi le cellule colpite possono diffondersi dal sistema circolatorio a quello nervoso centrale (cervello o spina dorsale) e, di conseguenza, causare una varietà di sintomi neurologici, come paralisi che interessano il viso o gli organi di senso, vomito e rallentamento del battito cardiaco.
Quando consultare il medico
Anche se qualcuno, o addirittura tutti, i disturbi (sintomi) sono presenti, è molto improbabile che la leucemia linfoblastica acuta ne sia la causa. Tuttavia, è bene consultare il medico di famiglia al più presto, perché qualunque sia la condizione che causa tali sintomi deve essere prontamente indagata e curata.
Cause
La leucemia linfoblastica acuta (LLA) origina nel midollo osseo, che è la sede in cui risiedono le cellule staminali che danno origine a tutte le cellule del sangue. In particolare il DNA di alcune cellule staminali di tipo linfoide, va incontro a gravi alterazioni genetiche. Queste alterazioni impediscono la completa maturazione e differenziazione dei linfociti, ma ne consentono una proliferazione incontrollata con conseguente accumulo di tali cellule anomale e mal funzionanti, nel midollo e nel sangue. Questo numero abnorme di cellule tumorali ostacola anche lo sviluppo delle cellule normali, portando, conseguentemente, una carenza di globuli rossi, granulociti e piastrine, situazione che causa i tanti disturbi associati alla malattia.
Fattori di rischio
Non è ancora possibile stabilire le cause precise delle mutazioni e, quindi, dei fattori di rischio che provocano la malattia. Si è osservato che, sebbene la maggior parte delle LLA si presentino in individui sani, si osserva una suscettibilità genetica ereditaria e ambientale come fattore di rischio in alcuni pazienti.
Malattie genetiche
Si ritiene che una piccola percentuale di casi di leucemia linfoblastica acuta infantile sia causata da anomalie genetiche correlate, come la sindrome di Down, di Klinefelter e di Bloom, o l'anemia di Fanconi. Esistono anche rare forme di LLA a tendenza familiare, associate alla presenza di mutazioni delle cellule germinali (spermatozoi e ovuli). Nei bambini affetti da tali anomalie i tassi di leucemia tendono ad essere più elevati. Tuttavia la base genetica sembra essere poligenica, cioè riguardante più geni varianti, spesso coinvolti nella proliferazione e differenziazione delle cellule del sangue.
Esposizione a radiazioni
L'esposizione prima o dopo la nascita a livelli molto elevati di radiazioni ionizzanti è un fattore di rischio noto. Per questo le indagini diagnostiche che prevedono l'utilizzo di radiazioni, come ad esempio i raggi X, sono effettuate sulle donne in gravidanza solo in caso di estrema necessità. Anche malati già sottoposti a radioterapia o a chemioterapia per tumori precedenti, non correlati alla leucemia linfoblastica acuta, hanno un rischio maggiore di svilupparla a causa del potere di indurre mutazioni di tali trattamenti.
Possibili fattori ambientali
Sono state condotte ricerche approfondite per determinare se fattori ambientali quali abitare nei pressi di una centrale nucleare o in prossimità di una linea elettrica, o ancora di un edificio o di impianti che generino campi elettromagnetici, possano rappresentare un fattore scatenante per la leucemia linfoblastica acuta. Allo stato attuale, non esistono prove certe che confermino che uno qualsiasi dei fattori citati aumenti il rischio di sviluppare la malattia. In ogni caso, i fattori ambientali solo raramente sembrano responsabili dello sviluppo di LLA.
Benzene e formaldeide
L'esposizione al benzene, sostanza contenuta nella benzina, in alcuni pesticidi e utilizzata nelle raffinerie e nell'industria della gomma, è un fattore di rischio noto per la leucemia linfoblastica acuta negli adulti. Per quanto riguarda le LLA pediatriche, un fattore di rischio potrebbe essere legato all'esposizione materna al benzene ambientale. È necessario sapere che il benzene si trova anche nel fumo delle sigarette.
Altra sostanza considerata fattore di rischio è la formaldeide, chiamata comunemente formalina. È una molecola utilizzata in ambito sanitario, poiché ha una potente azione battericida, si trova nei disinfettanti domestici e nella produzione dei tessuti. Inoltre è utilizzata tra gli additivi alimentari come conservante.
Altri fattori di rischio
Esistono alcune prove, nella letteratura scientifica, di un incremento del rischio di leucemia linfoblastica acuta in individui che hanno contratto infezioni nel periodo infantile, come, ad esempio, un’infezione da parvo virus B19, oppure in bambini che in utero, o subito dopo la nascita, hanno avuto una crescita più rapida del normale o nelle persone immunologicamente debilitate perché affette da AIDS o perché assumono farmaci immunosoppressori dopo un trapianto d'organo.
Diagnosi
I pazienti affetti da leucemia linfoblastica acuta solitamente riferiscono uno stato di malessere fin dall'esordio della malattia, quelli più frequenti sono: astenia, febbre, facilità a sviluppare ematomi spontanei o che compaiono dopo traumi leggeri.
Una visita medica completa è il punto di partenza obbligato per arrivare a una diagnosi di leucemia linfoblastica acuta (LLA). Il medico valuta la storia familiare, i disturbi (sintomi) e i segni clinici quali, ad esempio, la presenza di organi e linfonodi ingrossati, e decide se prescrivere eventuali esami di approfondimento. La prima analisi da fare è un esame emocromo - citometrico e uno striscio, attraverso un prelievo di sangue. Ciò permette di osservare la morfologia delle cellule (globuli bianchi, globuli rossi e piastrine), quantificarle e dare la percentuale di ciascuna popolazione all'interno dei globuli bianchi (granulociti neutrofili, eosinofili, basofili, monociti e linfociti). Inoltre, permette di identificare e quantificare le cellule immature di tipo tumorale.
Biopsia del midollo osseo
Per accertare (diagnosticare) la LLA, l'ematologo richiede successivamente il prelievo di un campione di midollo osseo, che si può ottenere sia aspirando una quantità di sangue midollare, sia prelevando un piccolo cilindro di osso insieme al midollo, entrambi introducendo un ago specifico per i due processi di solito nell'osso dell'anca o del bacino del paziente. Si tratta di una procedura breve, effettuata in anestesia locale, che normalmente non prevede ricovero.
I campioni biologici così prelevati servono a potere eseguire:
- analisi morfologica delle cellule, che permette di osservare le caratteristiche della loro forma, fornendo le prime informazioni importanti per la diagnosi della malattia
- analisi citogenetica, cioè l'esame del numero e della struttura dei cromosomi all'interno delle cellule, l'identificazione dei geni nel DNA. Queste sono informazioni molto importanti, perché alcune alterazioni cromosomiche possono essere associate ad una prognosi più o meno favorevole
- analisi immunofenotipica, cioè identificare le proteine presenti sulla superficie della membrana delle cellule tumorali, facilitando la diagnosi (per esempio, capire se la leucemia è di tipo B o T) e il monitoraggio della risposta alla terapia
- analisi molecolare, che permette di evidenziare i marcatori molecolari, cioè le alterazioni cromosomiche, che possono dare informazioni sulla prognosi e monitorare la risposta alla terapia
Un’ulteriore indagine è la reazione a catena della polimerasi (PCR), il test della PCR si esegue su un campione di sangue ed è importante sia per accertare la malattia, sia per monitorare la risposta alle cure. L'esame del sangue è ripetuto ogni tre mesi per almeno due anni dopo l'inizio della terapia e, una volta raggiunta la remissione della malattia, con meno frequenza.
Ulteriori accertamenti
Esistono altri esami, in grado di fornire ulteriori informazioni sullo stato di avanzamento e sull'estensione della malattia, che possono favorire l'orientamento verso la cura più adatta:
- biopsia del linfonodo, può essere eseguita più volte, in particolare quando si presenta l'ingrossamento di altri linfonodi. In questo modo è possibile stabilire fino a che punto la malattia si è diffusa
- TAC, risonanza magnetica, raggi X ed ecografia, questi esami di diagnostica per immagini sono utili per capire quanto e dove la malattia si sia diffusa e per determinare la presenza di eventuali altri problemi legati alla leucemia, come, per esempio, alcune infezioni
- esame del liquor, per verificare se la malattia ha raggiunto anche il sistema nervoso centrale, si esegue l'esame del liquor (il fluido che circonda e protegge il midollo vertebrale). Il campione è prelevato in anestesia locale dalla schiena mediante una puntura lombare (rachicentesi)
Terapia
La scelta della terapia della leucemia linfoblastica acuta (LLA) dipende da alcuni fattori: età e condizioni del paziente, sottotipo di LLA, presenza di malattia nel sistema nervoso centrale, presenza di infezioni alla diagnosi, storia di altre malattie mieloproliferative precedenti o di precedenti trattamenti radio-chemioterapici. In linea generale, dato il carattere acuto di questa leucemia, la cura deve essere iniziata subito dopo la diagnosi.
Il trattamento deve avvenire in centri specializzati di ematologia, dove vengono eseguiti dei protocolli codificati, simili in tutti i centri, basati sulla somministrazione di regimi di chemioterapia di prima o di seconda linea, sul trapianto di cellule staminali emopoietiche normali da donatore compatibile (trapianto di midollo osseo), di anticorpi monoclonali.
Le fasi di cura non sono uguali per tutti i malati e sono diverse per gli adulti rispetto ai bambini. In ogni caso per tutti i pazienti le fasi iniziali del trattamento sono comuni e sono rappresentate da: diagnosi della malattia e valutazione prognostica del sottotipo di LLA. Correntemente per le LLA di tipo B in età pediatrica, la terapia consiste in un trattamento standard, considerando l’età, la conta dei globuli bianchi, l’immunofenotipo e le caratteristiche citogenetiche della popolazione immatura. Include 4 fasi: induzione, consolidazione, intensificazione e mantenimento a lungo termine.
Il primo trattamento consiste in una chemioterapia di induzione della durata di 2/3 anni che punta ad eliminare il grosso della malattia, a riportare una ematopoiesi normale ed una remissione completa, condizione che si ottiene in un discreto numero di pazienti. L’induzione è basata su una combinazione di chemioterapici che, solitamente, include glucocorticoidi, vincristina, L- asparaginasi e un’antraciclina.
Il secondo step del trattamento è la consolidazione / intensificazione e consiste in alcuni brevi cicli sequenziali di chemioterapia, ogni 2 settimane, con citarabina, alte dosi di metotrexate, vincristina, asparaginasi, mercaptopurine e glucocorticoidi, per un periodo di 12 settimane. Questa sequenza è seguita da una fase di rafforzamento tardivo (terapia di reinduzione) che include una combinazione simile di farmaci usati durante la terapia di induzione.
La quarta fase è quella di mantenimento e consiste nella somministrazione di mercaptopurina tutti i giorni e metotrexate settimanalmente, con o senza vincristina e glucocorticoidi ogni 1/3 mesi. La terapia di mantenimento è somministrata per 2/3 anni dopo l’induzione, oltre non è stato dimostrato nessun beneficio. Insieme alla chemioterapia, è raccomandata una profilassi per il sistema nervoso centrale per prevenire una ricaduta della malattia in questa sede, perché le cellule di LLA possono annidarsi e crescere proprio in questi organi.
Trapianto midollare
Il trapianto allogenico è raccomandato in prima battuta per i sottotipi di LLA portatori di cromosoma Philadelphia, e per i pazienti con cromosoma Philadelphia negativo, che presentano una persistente malattia residua dopo induzione o consolidamento. Le cellule staminali ematopoietiche da utilizzare per il trapianto, potrebbero provenire oltre che da donatori compatibili, anche da cellule di cordone ombelicale umano.
Nuove terapie
Nell’ultimo decennio, alcune nuove terapie dirette contro specifiche proteine delle cellule tumorali (terapie bersaglio),sono state sviluppate per la leucemia linfoblastica acuta:
- Rituximab, un anticorpo anti CD20, proteina espressa sulle cellule di circa il 50% dei pazienti. Ha mostrato risultati promettenti negli adulti con ricaduta o in presenza di malattia refrattaria
- Inotuzumab ozogamicina, un anticorpo anti CD22, proteina presente nel 90% dei casi di LLA di tipo B
- Blinatumomab, un anticorpo anti CD19, proteina anch’essa presente nel 90% degli individui con LLA di tipo B
Studi molto recenti hanno consentito di sviluppare una nuova forma di terapia cellulare che si basa sull’utilizzo delle cosiddette CAR-T. Con il termine CAR-T si definisce un tipo di trattamento in cui i linfociti T prelevati dal paziente, vengono reinfusi nel suo organismo dopo essere stati modificati geneticamente in laboratorio, al fine di “armarli” contro le sue cellule leucemiche. La terapia con cellule CAR-T anti CD19 o anti CD22 è in grado di indurre elevate percentuali di remissioni complete in pazienti affetti da leucemia linfoblastica acuta di tipo B, anche con malattia in stadio avanzato.
È importante valutare l’efficacia del trattamento di tutte le terapie delle LLA, in prima battuta con gli esami del sangue, per questo recentemente si utilizza anche il dosaggio dei livelli di alcuni micro RNA (piccole porzioni di RNA con attività regolatorie specifiche per le varie funzioni cellulari) e delle interleuchine, come l’interleuchina 2 ed il suo recettore, che sono stati indicati come i marcatori biologici per questa patologia, in quanto si è visto un loro aumento nelle malattie mieloproliferative.
Complicazioni
Per alcuni dei malati affetti da leucemia linfoblastica acuta una delle possibili complicazioni è l'indebolimento del sistema di difesa dell'organismo (immunodeficienza) e quindi un maggiore rischio di infezioni. Questo può accadere sia per la mancanza di globuli bianchi sani, sia a causa dei farmaci utilizzati per la terapia. Ecco perché è importante riferire al proprio medico eventuali disturbi (sintomi) quali febbre alta, mal di testa, diarrea, stanchezza e dolore muscolare qualora durino nel tempo.
Proprio a causa del possibile indebolimento immunologico è importante evitare il contatto con persone infette, anche se si tratta di infezioni da cui si è già stati colpiti in passato come, ad esempio, morbillo o varicella. E mentre è auspicabile uscire regolarmente, è necessario evitare luoghi affollati inclusi locali e mezzi pubblici.
Emorragia
Altre complicazioni possibili sono: la facilità a sanguinare (emorragia) e la formazione di lividi a causa dei bassi livelli di piastrine nel sangue. In alcuni casi l'emorragia può essere grave e, a seconda del sito in cui si verifica, può essere definita intracranica, polmonare o gastrointestinale.
I disturbi (sintomi) causati dall'emorragia intracranica includono forte mal di testa, torcicollo, vomito, confusione e disorientamento. Quelli più comuni dell'emorragia polmonare sono tosse con sanguinamento dal naso e dalla bocca, difficoltà respiratoria e colorito bluastro delle mucose (cianosi). L'emorragia gastrointestinale, invece, si presenta più comunemente con vomito con sangue e feci molto scure. Tutti e tre i tipi di emorragie richiedono cure d'urgenza in ospedale.
Infertilità
Diversi farmaci utilizzati per curare la leucemia linfoblastica acuta possono causare infertilità, spesso temporanea, più di rado permanente. I malati più a rischio di infertilità sono quelli che ricevono dosi elevate di chemio o radioterapia per essere preparati al trapianto di midollo o di cellule staminali. Tuttavia, è possibile premunirsi dal rischio di infertilità conservando campioni di sperma o embrioni che poi possono essere reimpiantati a fine terapia.
Aspetti psicologici della leucemia linfoblastica acuta
Ricevere una diagnosi di leucemia linfoblastica acuta può essere molto doloroso. Parlare con un consulente o uno psicologo può aiutare a combattere i sentimenti di depressione e di ansia e consentire di fronteggiare meglio la situazione aumentando la probabilità di guarigione.
Vivere con
Può essere difficile venire a sapere, al termine del percorso di accertamento (diagnosi), di essere malati di cancro, sia praticamente che emotivamente. Nello specifico della leucemia linfoblastica acuta è ancora più difficile perché spesso ci si ammala improvvisamente e c’è poco tempo per informarsi e affrontare la situazione consapevolmente prima di iniziare la cura.
Come cambia l'aspetto fisico
Stanchezza e perdita dei capelli sono gli effetti fisici più comuni che compaiono nel corso delle cure. A fine trattamento scompariranno, anche se, in alcuni casi, i capelli potrebbero ricrescere in modo leggermente diverso da prima. Altre modificazioni dipendono dal tipo di cura ricevuta. Ad esempio, se si è stati sottoposti a radioterapia totale, tutta la pelle potrebbe diventare più sensibile ai raggi del sole e avere bisogno, quindi, di una maggiore protezione; in alcuni casi, si potrebbero osservare variazioni permanenti, in più o in meno, del peso.
Affrontare la leucemia linfoblastica acuta nella pratica
Così come la comunicazione di essere malati va affrontata dal punto di vista emotivo, altrettanto si deve fare per gestire gli aspetti pratici della vita, dalle questioni economiche a quelle familiari fino a quelle strettamente personali. Non è necessario affrontare e risolvere tutto da soli e tutto in una volta, un colloquio con il medico o l'infermiere specializzato può essere d'aiuto.
Tornare alla normalità dopo la terapia
Non sempre è semplice tornare alla normalità a fine cura. Ci si può sentire frustrati e aver bisogno di tempo per recuperare il ritmo quotidiano. Andare in vacanza, concentrarsi sul lavoro o fare programmi per il futuro sono solo alcuni dei modi possibili per riprendere una vita normale in modo progressivo. Quello che più conta, però, è cercare di tornare a svolgere le proprie attività solo quando davvero ci si sente pronti.
Link di approfondimento
Associazione Italiana per la Ricerca sul Cancro (AIRC). Leucemia linfoblastica acuta
Huang FL, Liao EC, Li CL, Yen CY and Yu SJ. Pathogenesis of pediatric B-cell acute lymphoblastic leukemia: Molecular pathways and disease treatments. Oncology Letters. 2020; 20(1):448-454
Davids MS. Acalabrutinib for the initial treatment of chronic lymphocytic leukaemia. The Lancet. 2020; 395(10232):1234-1236
Prossimo aggiornamento: 24 Ottobre 2027




























