Introduzione

Con il termine bifenili policlorurati o policlorobifenili (PCB) si indica una miscela di idrocarburi clorurati usata dal 1930 per diversi scopi industriali. La struttura di base dei PCB è rappresentata nella figura 1.
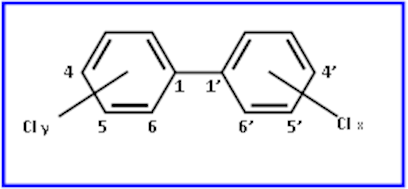
Fig. 1. Struttura generale dei policlorobifenili (PCB)
Le diverse combinazioni determinate dal numero e dalla posizione degli atomi di cloro presenti nella molecola possono dare luogo a 209 diversi composti o congeneri. Le proprietà chimico-fisiche dei singoli congeneri, e la loro tossicità, dipendono essenzialmente dal numero degli atomi di cloro e dalla loro posizione.
I PCB sono stati ampiamente utilizzati come fluidi dielettrici nei trasformatori e nei condensatori elettrici in quanto sono ottimi isolanti, sono conduttori elettrici non infiammabili e chimicamente stabili; inoltre, sono stati impiegati anche come fluidi idraulici, veicolanti o diluenti sinergici dei pesticidi, plastificanti, ritardanti di fiamma, fungicidi, componenti di vernici.
La produzione industriale dei PCB è stata interrotta o drasticamente ridotta fra gli anni ’70 e gli anni ’90 a livello mondiale e ne è stata vietata la produzione e l’importazione nei Paesi della Comunità Europea. Ciò nonostante, ancora oggi si hanno diverse fonti di PCB, quali l’utilizzo dei fanghi, provenienti dalla depurazione di acque di scarico, come fertilizzanti, alcuni processi di combustione in cui questi inquinanti si formano come sottoprodotti, scarichi illeciti, pratiche di errato smaltimento. A causa del loro vasto impiego, della loro elevata persistenza e di un frequente improprio smaltimento, i PCB sono contaminanti presenti ovunque nell’ambiente (aria, acqua, suolo). In conseguenza della loro elevata capacità di sciogliersi (solubilità) nei grassi ma scarsa in acqua, e della loro resistenza alla degradazione chimica, fisica e biologica, essi tendono ad accumularsi nella componente organica del suolo e dei sedimenti, ad essere assorbiti dalle piante e quindi ingeriti dagli animali che se ne nutrono, entrando così nella catena alimentare. All’interno di un organismo i PCB tendono ad accumularsi nel grasso e sono eliminati in tempi molto lunghi. Ne consegue che la loro concentrazione aumenta lungo la catena alimentare passando da un organismo di livello inferiore a uno di livello superiore, soprattutto se si tratta di un grande predatore. Questo fenomeno è noto col nome di biomagnificazione.
Solo 12 dei 209 congeneri dei PCB presentano caratteristiche chimico-fisiche e tossicologiche paragonabili a 2,3,7,8-TCDD, il congenere più tossico della famiglia delle diossine e sono chiamati per questo diossina-simili o dioxin-like (DL-PCB). Gli effetti tossici diossina-simili dipendono dalla capacità di assumere una configurazione simile a quella della diossina. I restanti congeneri, detti PCB non diossina simili e indicati come NDL-PCB, sono i congeneri più importanti a livello di esposizione perché di gran lunga i più abbondanti nell’ambiente e negli alimenti. Tra questi PCB si distinguono i cosiddetti indicatori, ossia sei congeneri indicati con i seguenti numeri in funzione del numero e della posizione degli atomi di cloro: PCB 28, PCB 52, PCB 101, PCB 138, PCB 153 e PCB 180. La loro concentrazione rappresenta circa la metà della concentrazione totale di tutti i PCB non diossina-simili presenti nei mangimi e nei prodotti alimentari.
Fonti di esposizione e livelli nell'uomo
Il contributo maggiore all’esposizione umana, circa il 90%, è legato alla dieta, soprattutto al consumo di cibi di origine animale, sebbene altre vie di esposizione siano da considerare, quali l’assorbimento attraverso la pelle, l’inalazione di pulviscolo atmosferico, l’ingestione di suolo contaminato o di acqua.
La quantità di PCB presente nell’organismo, ossia la dose interna, è il risultato dell’esposizione avvenuta nel tempo e attraverso le diverse fonti espositive, dovuta allo scarso metabolismo di questi composti e alla loro tendenza ad accumularsi nel tessuto grasso ma anche a comportamenti o stili di vita che ne possono favorire l’esposizione. Oggi i livelli di PCB nell’uomo sono in genere più bassi rispetto al passato e, comunque, in continua diminuzione in seguito al divieto di produzione e ai limiti di uso di questi prodotti imposti a livello europeo e mondiale. Tuttavia, rimane la necessità di controllare l’esposizione poiché, proprio recentemente, l’Autorità Europea per la Sicurezza Alimentare (EFSA) ha valutato che l’assunzione di DL-PCB e diossine supera la dose settimanale tollerabile in tutte le fasce di età della popolazione. Per garantire la protezione della salute, negli ultimi anni sono aumentati in modo importante gli studi di biomonitoraggio umano per la valutazione dei livelli interni di esposizione, che, nel caso dei PCB, sono determinati attraverso l’analisi di campioni biologici, prevalentemente siero o latte materno. Inoltre, il biomonitoraggio permette di individuare aree geografiche o sottogruppi di popolazioni maggiormente esposti, di intraprendere le necessarie azioni per accertarne le possibili fonti e indicare eventuali comportamenti da assumere per limitarla.
Effetti sulla salute umana
L’Agenzia Internazionale per la Ricerca sul Cancro (International Agency for Research on Cancer, IARC) classifica i PCB quali sostanze cancerogene per l’uomo (gruppo 1 della classificazione). Infatti, l’associazione tra esposizione a PCB e il melanoma è stata accertata in studi occupazionali e in studi sulla popolazione generale, con un chiaro rapporto dose-risposta; inoltre, l’evidenza a favore di un’associazione tra i PCB e linfomi non Hodgkin e per il cancro della mammella è stata definita limitata.
I DL-PCB e NDL-PCB agiscono attraverso diversi meccanismi di tossicità derivanti dal numero e dalla posizione degli atomi di cloro. Per i DL-PCB, studi sui roditori hanno dimostrato che gli effetti critici provocati alla dose più bassa utilizzata riguardano il sistema metabolico, in particolare il fegato, la riduzione della quantità di spermatozoi, il ritardo dello sviluppo sessuale e l’alterazione dei parametri ossei (EFSA 2019). Il comune meccanismo di azione dei DL-PCB ha permesso lo sviluppo di fattori di tossicità equivalente, ossia valori compresi tra zero e uno attribuiti ad ogni congenere che “pesano” la tossicità del singolo congenere rispetto a quella del 2,3,7,8-TCDD posta uguale a 1. In tal modo il rischio per la salute umana derivante dall’esposizione a PCB diossina-simili viene valutato sulla base della loro concentrazione totale espressa in equivalenti di tossicità (TEQ). Sommando i TEQ, si ottiene un solo dato che indica a quanta TCDD equivalgano tutti i congeneri dosati.
I NDL-PCB mostrano una marcata affinità per i recettori degli estrogeni, ma interagiscono anche con altri recettori cellulari, con effetti critici a carico di fegato e tiroide, del sistema immunitario, dell’apparato riproduttivo e del sistema metabolico (EFSA 2005). I NDL-PCB sono di grande interesse a livello tossicologico anche perché, mediante il meccanismo di trasformazione (metabolismo), danno luogo a sostanze che possono essere anch’esse tossiche.
I PCB sono anche elencati tra gli interferenti endocrini poiché in grado di alterare i livelli di estrogeni, androgeni, ormoni tiroidei e degli ormoni che regolano il metabolismo, con effetti sui sistemi endocrino e metabolico ad esso connesso.
La popolazione è esposta contemporaneamente a DL-PCB e a NDL-PCB dunque è particolarmente difficile distinguerne gli effetti. Studi epidemiologici hanno dimostrato che l’esposizione può essere associata a insorgenza di patologie riproduttive sia maschili che femminili, a ridotta fertilità maschile causata da diminuzione del numero degli spermatozoi, criptorchidismo, ipospadia, endometriosi, ovario policistico, ritardi dello sviluppo neurologico. In particolare, è stato evidenziato che l’esposizione durante la gravidanza e la pubertà può comportare lo sviluppo di tali malattie in età adulta. Tuttavia, per molte di esse gli studi condotti hanno prodotto risultati contrastanti e non si hanno dati sufficienti per poter effettuare una valutazione del rischio.
Prevenzione e controllo
L’inquinamento provocato dai PCB è un problema mondiale. Negli ultimi 30 anni la loro presenza in alimenti e mangimi è diminuita grazie alle numerose azioni normative intraprese, a livello comunitario e internazionale, per cercare di ridurne l’impatto sull’ambiente e sulla salute.
Un importante contributo alla riduzione della presenza di questi contaminanti nell’ambiente è stato determinato dalla loro inclusione nella Convenzione di Stoccolma sui contaminanti organici persistenti (POP). Adottata a maggio del 2001, è entrata in vigore nel 2004; vi hanno aderito 181 Parti tra cui l’Unione Europea. La Convenzione ha individuato una serie di POP di particolare interesse tossicologico di cui ha vietato produzione e uso a meno di specifiche esenzioni, ai fini della salvaguardia dell’ambiente e della salute umana.
Poiché per l’uomo la via di esposizione predominante ai PCB è quella alimentare, nei Paesi europei i limiti di concentrazione di PCB (DL e NDL) e diossine presenti negli alimenti sono regolati per legge (Regolamento UE 1259/2011), tenendo conto delle valutazioni di rischio effettuate dall’Agenzia Europea sulla Sicurezza Alimentare (European Food Security Authority, EFSA).
Nei Paesi europei le concentrazioni di PCB negli alimenti sono controllate periodicamente attraverso specifici programmi di sorveglianza. In Italia, la ricerca dei PCB diossina simili e dei sei indicatori non diossina simili rientra nel Piano Nazionale Residui (PNR), che mira ad “esaminare e porre in evidenza le ragioni dei rischi di residui nei prodotti alimentari di origine animale provenienti dagli allevamenti, dai mattatoi, dai centri di raccolta latte e uova, dagli impianti di acquacoltura.” Esso viene elaborato annualmente, in collaborazione con le Regioni e le Province Autonome, i Laboratori Nazionali di Riferimento per i residui e gli Istituti Zooprofilattici Sperimentali, tenendo conto degli aggiornamenti scientifici/normativi, delle specifiche richieste della Commissione europea e dei Laboratori Comunitari di Riferimento per i residui, e delle segnalazioni di allerta attivate negli anni precedenti relative a residui chimici in alimenti e mangimi.
Bibliografia
Aoki Y. Polychlorinated Biphenyls, Polychlorinated Dibenzo-p-dioxins, and Polychlorinated Dibenzofurans as Endocrine Disrupters - What we have Learned from Yusho Disease [Sintesi]. Environmental Research. 2001; 86: 2-11
Crain D, Janssen S, Edwards T, Heindel J, Ho S, Hunt P, Iguchi T, Juul A, McLachlan J, Schwartz J, Skakkebaek N, Soto A, Swan S, Walker C, Woodruff T, Woodruff T, Giudice L, Guillette Jr L. Female reproductive disorders: the roles of endocrine-disrupting compounds and developmental timing. Fertility and Sterility. 2008; 90(4): 911-940
EFSA Panel on Contaminants in the Food Chain (CONTAM), Knutsen H K, Alexabder J, Barregard L, Bignami M et al. Risk for animal and human health related to the presence of dioxins and dioxin-like PCBs in feed and food. EFSA Journal. 2018; 16(11). doi: 10.2903/j.efsa.2018.5333
EFSA Panel on Contaminants in the Food Chain. Opinion of the Scientific Panel on contaminants in the food chain (CONTAM) related to the presence of non dioxin‐like polychlorinated biphenyls (PCB) in feed and food. EFSA Journal. 2005; 3(11). doi:10.2903/j.efsa.2005.284
Grandjean P, Landrigan PJ. Developmental neurotoxicity of industrial chemicals [Sintesi]. Lancet. 2006; 368(9553): 2167-2178
Hood A, Klaassen C D. Effects of Microsomal Enzyme Inducers on Outer-Ring Deiodinase Activity toward Thyroid Hormones in Various Rat Tissues [Sintesi]. Toxicology and Applied Pharmacology. 2000; 163(3): 240-248
International Agency for Research on Cancer (IARC). Polychlorinated and polybrominated biphenyls. 2016 (IARC monographs on the evaluation of carcinogenic risks to humans, volume 107)
Le Magueresse-Battistoni B, Labaronne E, Vidal H, Naville D. Endocrine disrupting chemicals in mixture and obesity, diabetes and related metabolic disorders. World journal of biological chemistry. 2017; 8(2): 108-119. doi: 10.4331/wjbc.v8.i2.108
Mocarelli P, Brambilla P, Gerthoux PM, Patterson DG Jr, Needham LL. Change in sex ratio with exposure to dioxin. Lancet. 1996; 348(9024): 409
Porpora M G, Medda E, Abballe A, Bolli S, De Angelis I, di Domenico A, Ferro A, Ingelido A M, Maggi A, Benedetti Panici P, De Felip E. Endometriosis and Organochlorinated Environmental Pollutants: A Case–Control Study on Italian Women of Reproductive Age. Environmental Health Perspectives. 2009; 117( 7): 1070-1075
Shi H, Jan J, Hardesty JE, Falkner KC, Prough RA, Balamurugan AN, Mokshagundam SP, Chari ST, Cave MC. Polychlorinated biphenyl exposures differentially regulate hepatic metabolism and pancreatic function: Implications for nonalcoholic steatohepatitis and diabetes. Toxicology and applied pharmacology. 2019; 363: 22-33. doi: 10.1016/j.taap.2018.10.011
Sikka SC, Wang R. Endocrine disruptors and estrogenic effects on male reproductive axis. Asian Journal of Andrology. 2008; 10(1): 134-145
Stecca L, Tait S, Corrado F, Esposito M, Mantovani A, La Rocca C. Development of an in vitro test battery model based on liver and colon cancer cell lines to discriminate PCB mixtures by transcription factors gene expression analysis. Toxicolology in vitro: an international journal published in association with BIBRA. 2016; 34: 204-211
Van den Berg M, Birnbaum LS, Denison M, De Vito M, Farland W, Feeley M, Fiedler H, Hakansson H, Hanberg A, Haws L, Rose M, Safe S, Schrenk D, Tohyama C, Tritscher A, Tuomisto J, Tysklind M, Walker N, and Peterson RE. The 2005 World Health Organization Re-evaluation of Human and Mammalian Toxic Equivalency Factors for Dioxins and Dioxin-like Compounds. Toxicololgical sciences: an official journal of the Society of Toxicology. 2006; 93(2): 223-241
Link approfondimento
Agenzia per la protezione dell'ambiente e per i servizi tecnici (APAT). Diossine Furani e PBC
Istituto Superiore per la Protezione e la Ricerca Ambientale (ISPRA). Diossine, Furani e PBC
Stockholm Convention on Persistent Organic Pollutants
Prossimo aggiornamento: 19 Novembre 2023




























